Circulation | 上海交通大学卜军团队发现腹主动脉瘤形成的新机制
腹主动脉瘤是一种严重的主动脉疾病,目前尚无有效的药物治疗方法。核激素受体LXRα(肝脏X受体α)由NR1H3 基因编码,是与几种血管病变相关的关键转录介质,但其在AAA中的作用尚不清楚。
2024年4月2日,上海交通大学卜军团队在Circulation在线发表题为“LXRα Promotes Abdominal Aortic Aneurysm Formation Through UHRF1 Epigenetic Modification of miR-26b-3p”的研究论文,该研究发现LXRα通过UHRF1表观遗传修饰miR-26b-3p促进腹主动脉瘤形成。在AAA患者和血管紧张素II或CaCl2处理小鼠的主动脉中观察到LXRα上调。在2种小鼠模型中,敲除全局或血管平滑肌细胞特异性Nr1h3可抑制AAA的形成。LXRα功能的丧失可阻止细胞外基质变性、炎症和血管平滑肌细胞表型转换。
通过转录组测序和染色质免疫沉淀测序的综合分析,发现表观遗传主调控因子Uhrf1是LXRα的直接靶基因。在血管紧张素II和CaCl2诱导的小鼠模型中,UHRF1(泛素样含有PHD和RING finger结构域1)一致增强了AAA发展的易感性。然后,在血管平滑肌细胞中使用CUT&Tag(靶下切割和标记)、RRBS(亚硫酸氢盐还原测序)和ATACseq(转座酶可及染色质测序)测定了UHRF1介导基因的CpG甲基化状态和启动子可及性,结果表明,UHRF1募集到miR-26b的启动子导致DNA超甲基化,并伴有相对封闭的染色质状态。miR-26b-3p的低表达与AAA患者的高风险相关,维持miR-26b-3p的表达可以阻止AAA的进展,缓解整体病理过程。该研究揭示了LXRα/UHRF1/miR-26b-3p轴在AAA中的关键作用,并为AAA提供了潜在的生物标志物和治疗靶点。

腹主动脉瘤(AAA)被定义为主动脉的局灶性和永久性扩张。如果动脉瘤破裂,死亡率超过80%。AAA的临床治疗主要通过手术干预实现,包括切开修复和血管内动脉瘤修复。AAA患者残疾和死亡的风险很高由于缺乏有效的药物治疗方案,寻找治疗AAA的新靶点成为当务之急。
LXRα(肝脏X受体α)是一种由Nr1h3基因编码的多功能核受体蛋白。LXRα在代谢活跃的系统中大量表达,包括肝、肾、肠、心脏和脂肪组织,以及各种血管细胞。除了其在脂质和葡萄糖代谢稳态和疾病中的既定作用外,新的证据表明LXRα可能调节多种心血管疾病。
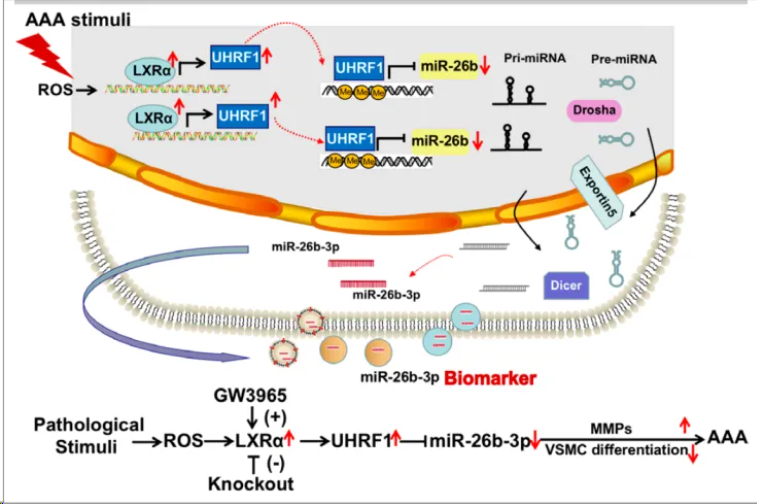
LXRα在腹主动脉瘤发病机制中的模型(图源自Circulation )
DNA甲基化是DNA的主要表观遗传特征,具有多种功能它通过启动子的超甲基化来抑制不需要的基因的表达,这被特定的转录因子(TFs)或甲基CpG结合蛋白识别,这些转录因子或甲基CpG结合蛋白招募组蛋白修饰剂或染色质重塑蛋白来动态调节染色质组织。越来越多的研究提供了令人信服的证据,证明AAA与异常DNA甲基化之间存在相关性;然而,对AAA中DNA甲基化机制的研究有限。
该研究表明,LXRα缺失在AAA中发挥保护作用,LXRα/ UHRF1/miR-26b-3p相互作用的发现拓宽了人们对AAA致病事件的认识,该信号通路的激活决定了AAA形成过程中VSMC功能、MMP活性和炎症之间的平衡。此外,miR-26b-3p在AAA中的鉴定表明,它可能被用作这种疾病的一种新的诊断生物标志物,特别是用于临床。
原文链接:
https://doi.org/10.1161/CIRCULATIONAHA.123.065202
来源 | iNature(公众号)
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






