Circ Res | 同济大学陈义汉/梁丹丹发现转录因子SP1缺乏与肥厚性心肌病有关
肥厚性心肌病(HCM)是最常见的单基因心脏疾病。然而,HCM的发病机制,尤其是其非遗传机制,在很大程度上仍不清楚。
2024年1月10,同济大学陈义汉及梁丹丹共同通讯在Circulation Research 在线发表题为“Deficiency of Transcription Factor SP1 Contributes to Hypertrophic Cardiomyopathy”的研究论文,该研究表明转录因子SP1缺乏与肥厚性心肌病有关。Sp1小鼠的心脏特异性条件敲除产生典型的HCM表型,表现出明显的心肌肥大、间质纤维化和肌丝紊乱。Sp1敲低显著增加了hiPSC-CMs的细胞面积,并引起细胞内肌原纤维紊乱,这与HCM的肥厚心肌细胞相似。
机制上,Tuft1被确定为SP1的关键靶基因。在hiPSC-CMs和小鼠中,Sp1敲除诱导的肥厚表型可以通过TUFT1 (tuftelin 1)的过表达来恢复。此外,SP1过表达抑制了Myh6 R404Q/+突变等位基因中HCM的发展,并逆转了HCM的肥厚表型。该研究表明SP1缺乏导致HCM。SP1过表达对HCM小鼠和HCM hiPSC-CMs均有显著的治疗作用,提示SP1可能是HCM的潜在干预靶点。

肥厚性心肌病(HCM)是一种常见的遗传性心血管疾病,约占成年人口的0.2%,是心源性猝死和心力衰竭的重要危险因素。目前,治疗HCM主要采用β受体拮抗剂和非二氢吡啶类钙通道阻滞剂;然而,效果并不理想。HCM的主要病理改变是心肌肥大和间质纤维化,不幸的是,这些药物不能逆转。其他治疗,包括心脏起搏、化学消融和手术切除,可能昂贵、复杂或有创性。基因突变被认为是HCM的主要原因;然而,基因治疗等最先进的技术在临床实践中仍然无法适用于患者。从不同的角度探索HCM的发病机制和新的干预靶点仍然是心脏病学领域的主要挑战之一。
转录因子(TFs)是一类序列特异性的DNA结合蛋白,在物种间高度保守。新出现的证据揭示了它在多个监管网络中的中心地位。TF表达的改变导致了生物信号的级联反应此外,TFs与DNA的相对特异性结合使其具有独特的靶向干预优势。然而,关于TFs在心脏病中的作用的机制研究仍然有限,特别是在HCM中。SP1(特异性蛋白1)是第一个从哺乳动物中分离纯化的TF,也是Sp/KLF家族中最活跃的转录激活因子。SP1已被证明参与多种生物学过程,特别是肿瘤的发生和生长。SP1抑制剂,如米霉素A,因其对肿瘤的显著治疗作用而被应用于临床治疗。然而,SP1在心脏中的作用尚不清楚。
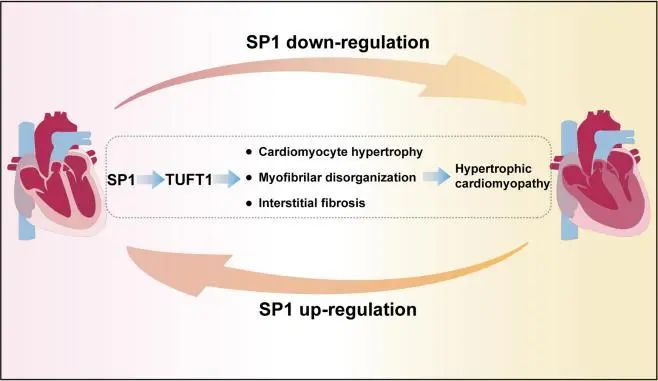
机理模式图(图源自Circulation Research )
该研究揭示了Sp1在HCM的发病机制和潜在干预中的作用。Sp1 (Sp1-CKO)小鼠的心脏特异性条件敲除表现出明显的心脏肥大和心肌纤维化。Tuft1被确定为SP1的关键靶基因,其在Sp1-CKO心脏中的表达显著降低。此外,心脏特异性敲低Tuft1可导致小鼠HCM。在人诱导的多能干细胞来源的心肌细胞(hiPSC-CMs)和成年小鼠中,过度表达TUFT1 (tuftelin 1)可减弱Sp1缺陷引起的HCM表型。
该研究证实了SP1对Myh6 R404Q/+ (R404Q)突变等位基因小鼠HCM的治疗作用。在HCM患者的hiPSC-CMs中,SP1或TUFT1过表达也显著减轻心肌细胞肥大和细胞内肌原纤维的破坏。总之,该研究揭示了SP1在HCM的发生和发展中的作用,超出了HCM作为一种遗传疾病的理解。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.123.323272
来源 | iNature(公众号)
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






