Hepatology:中山大学肖振东团队发现假尿嘧啶合成酶1通过mRNA假尿嘧啶化促进肝癌,增强致癌mRNA的翻译
假尿苷是一种常见的RNA修饰,并在肝细胞癌(HCC)患者的血清和尿液中高度存在。然而,假尿苷化及其修饰酶在HCC中的作用仍然未知。
2024年10月,中山大学肖振东独立通讯在Hepatology (IF=12.9)在线发表题为“Pseudouridine synthase 1 promotes hepatocellular carcinoma through mRNA pseudouridylation to enhance the translation of oncogenic mRNAs”的研究论文。该研究通过分析TCGA数据集,发现PUS1在人类HCC标本中显著上调,并与肿瘤等级和HCC的不良预后呈正相关。
PUS1的敲低抑制了细胞增殖并减少了皮下异种移植小鼠模型中的肿瘤生长。相应地,在PUS1过表达的细胞中,观察到细胞增殖和肿瘤生长显著增加。此外,PUS1过表达显著加速了通过动态尾静脉注射建立的小鼠HCC模型中的肿瘤形成,而PUS1的敲除则减少了肿瘤形成。此外,PUS1的催化活性对于HCC肿瘤发生是必需的。在机制方面,作者通过利用载脂蛋白B mRNA编辑酶1(APOBEC1)介导的分析方法,确定了PUS1的mRNA靶标,发现PUS1将假尿苷引入一组癌基因的mRNA中,从而增强了这些mRNA的翻译能力。作者的研究突出了PUS1和假尿苷化在HCC发展中的关键作用,并提供了新的见解,即PUS1通过假尿苷化介导的mRNA翻译,增强了一组癌基因(包括胰岛素受体底物1(IRS1)和c-MYC)的蛋白质水平。

RNA修饰提供了一种高度特异且有效的方式来调控RNA的表达和功能,而无需改变其底层序列。已经发现了超过170种不同的RNA修饰。在过去的二十年中,越来越多的证据表明,这些修饰在生理和病理条件下发挥着关键作用。m6A是真核信使RNA (mRNA)中最常见的RNA修饰,它是基因表达的重要调节因子。例如,m6A“写入”甲基转移酶样蛋白3 (METTL3)/甲基转移酶样蛋白14 (METTL14)复合物将m6A修饰引入mRNA,而“擦除”蛋白FTO和ALKBH5则通过氧化去甲基化m6A来共同改变细胞的m6A水平。读者蛋白识别并结合含有m6A的转录本,通过调节mRNA代谢过程(包括剪接、降解和翻译)来调控基因表达。最近,在高通量RNA修饰位点检测的进展中,发现了其他RNA修饰,例如假尿苷 (ψ),也存在于mRNA的内部。然而,其功能和修饰酶仍然大多未被探索。
假尿苷是尿苷的一种异构体,由假尿苷合成酶 (PUS) 催化。假尿苷的掺入通过两种机制进行:一种是依赖RNA的小核仁核蛋白 (snoRNP) 的RNA依赖机制,另一种是PUS单独修饰其底物的RNA非依赖机制。H/ACA snoRNPs是两大类小核仁RNPs之一。除了在核糖体RNA (rRNA) 加工和端粒DNA合成中的作用外,其主要功能是指导假尿苷在目标RNA(包括rRNA和剪接体小核RNA)中的位点特异性合成。在人类中有13种PUS,它们被分为5个家族。截至目前,已有研究报道了某些PUS修饰了人类的mRNA。最近的研究表明,PUS可能在转录过程中修饰了人类pre-mRNA,并可能调节替代pre-mRNA剪接和3'末端加工。大量研究表明,假尿苷化及PUS的失调与多种疾病相关,但ψ和PUS蛋白的生物学作用仍然理解不足。
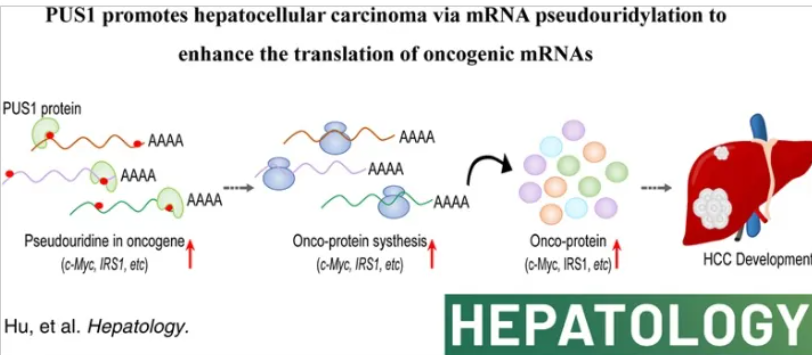
模式机理图(图片源自Hepatology )
尽管假尿苷存在于大多数RNA中,包括mRNA,其确切的mRNA位点仅在最近才开始被揭示。几组研究人员利用化学处理和高通量测序方法绘制了ψ在哺乳动物转录组中的位点。这些发现表明,ψ在哺乳动物mRNA上的分布具有组织特异性、细胞类型特异性和应激响应性。然而,特定PUS修饰的ψ位点的鉴定仍然模糊。一些研究尝试通过PUS基因敲除后绘制ψ位点的变化来确认这些位点,但由于其他PUS可能具有功能冗余性,这种方法可能低估了实际的ψ位点。因此,开发一种能够在疾病背景下识别不同PUS的mRNA底物的方法,将有助于更好地理解PUS和mRNA假尿苷化在包括癌症在内的疾病中的功能和潜在机制。
原发性肝癌是全球癌症相关死亡的第三大原因,并带来了显著的疾病负担。肝细胞癌(HCC)约占80%的肝癌病例,使其成为最常见的肝癌形式。尽管在早期诊断和治疗方面取得了相当大的进展,HCC患者的预后仍然严峻。因此,进一步探讨HCC的发病机制将为发现更有效的诊断和治疗方法提供理论基础。m6A RNA修饰在HCC中的作用已被广泛研究。例如,METTL3在HCC中高表达,并通过依赖m6A的机制促进了HCC的进展。还发现METTL3与HCC中的耐药性发展有关。然而,其他修饰及其修饰酶,尤其是自1988年以来在HCC患者血清和尿液中升高的假尿苷,对HCC的影响仍然大多未知。
最近,Jin等人发现了七种假尿苷合成酶在HCC中显著上调。其中,DKC1、PUS1和PUS7的水平与较差的生存率相关,表明PUS可能在HCC的发展中起着关键作用。已有研究报道了DKC1介导了肝细胞癌细胞的恶性发展和生存,而PUS7介导的tRNA假尿苷化则被证明抑制了胶质母细胞瘤的肿瘤形成。然而,PUS1在HCC中的具体作用和机制仍需进一步阐明。
在本研究中,作者发现PUS1 mRNA和蛋白水平在HCC患者中显著升高,高表达的PUS1与较差的预后相关。作者进一步证明了PUS1通过mRNA假尿苷化依赖的机制在HCC中发挥了促癌作用,促进了细胞增殖。通过利用Surveying Targets by APOBEC1-Mediated Profiling (STAMP),一种由DART-seq派生的方法,作者将PUS1与胞嘧啶脱氨酶APOBEC1融合,鉴定了PUS1的mRNA靶标。值得注意的是,PUS1靶向mRNA中癌基因显著富集。此外,这些癌基因中的假尿苷掺入增强了它们的翻译能力,而不改变其mRNA表达。总体而言,作者的研究为HCC中mRNA假尿苷化的调控提供了新的见解,并为基于RNA修饰的潜在治疗策略提供了分子基础。
原文链接:
https://doi.org/10.1097/HEP.0000000000000702
来源 | iNature
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






