NSR | 南京大学郭子健/李劼通过顺铂与STING激动剂联合应用于肿瘤金属免疫治疗
越来越多的证据表明,结合DNA损伤剂和干扰素基因刺激剂(STING)激动剂的策略是很有前途的癌症治疗方案,因为它们可以放大STING激活效应并重塑免疫抑制的肿瘤微环境。然而,包含这两种药物的单一分子实体尚未被开发出来。
2024年1月17日,南京大学郭子健及李劼共同通讯在National Science Review(IF=21)在线发表题为“Combining cisplatin and a STING agonist into one molecule for metalloimmunotherapy of cancer ”的研究论文,该研究设计了两种PtIV-MSA-2偶联物(I和II),包含DNA损伤化疗药物顺铂和先天免疫激活STING激动剂MSA-2;这些偶联物作为多特异性小分子抗胰腺癌药物具有很大的潜力。
机制研究表明,偶联物1上调了肿瘤细胞中与先天免疫和代谢相关的转录本的表达,与顺铂和MSA-2有显著差异。对肿瘤微环境的分析表明,偶联物I可以增强自然杀伤细胞(NK)向肿瘤的浸润,促进肿瘤组织中T细胞、NK细胞和树突状细胞(DCs)的活化。这些发现表明,将Pt化疗药物和STING激动剂结合到一个分子中产生的偶联物I是一种有前途的有效的抗癌候选药物,为基于小分子的癌症金属免疫治疗开辟了新的途径。

在过去的十年中,新兴的癌症免疫疗法(CITs)在各种肿瘤中取得了巨大的临床成功,然而只有一小部分具有某些免疫敏感癌症类型的患者通过这些疗法获得了改变生活的持久生存。目前,大多数CITs,如免疫检查点阻断(ICB)和过继细胞转移(ACT)为基础的疗法,通过操纵T细胞来增强抗肿瘤适应性免疫反应。然而,免疫抑制性肿瘤微环境(TME)通常以显著缺乏T细胞浸润为特征,这通常被认为是免疫“冷”肿瘤的特征。在许多肿瘤组织中,先天免疫细胞的浸润往往比T细胞多,这些细胞可以转化为吸引和诱导抗原特异性T细胞。因此,启动和激活先天免疫的分子已被认为是将“冷”肿瘤微环境转化为“热”肿瘤微环境的有吸引力的策略。
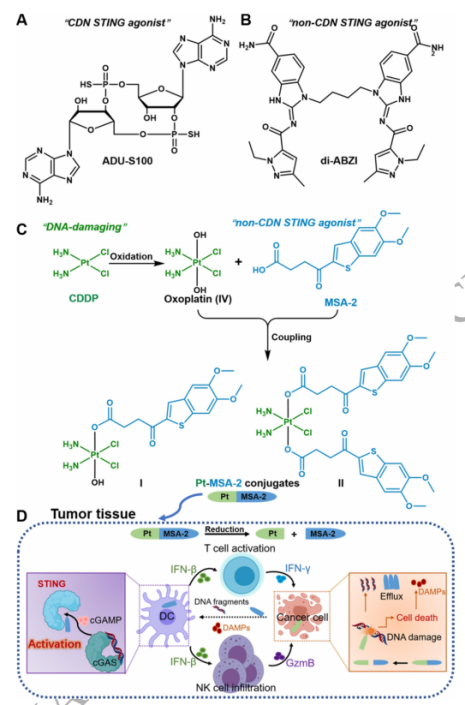
干扰素基因环GMP-AMP合成酶刺激因子(cGAS-STING)作为胞质DNA感应通路,参与调节基本的先天免疫通路。越来越多的证据表明,cGAS-STING通路的激活有利于杀瘤免疫。cGAS-STING介导的下游干扰素(IFNs)不仅可以激活先天免疫,还可以促进T细胞启动和肿瘤浸润。因此,越来越多的研究集中在STING激动剂的合成和筛选上。第一代STING激动剂是环二核苷酸(CDN)类似物;然而,它们的稳定性和细胞渗透性差,以及对肿瘤内递送的要求限制了它们在一小部分肿瘤中的应用。
最近,一些非基于CDN的人STING激动剂(如di-ABZI和MSA-2)被报道用于全身给药,显示出很强的抗肿瘤活性,显示出开发靶向STING途径的CITs的巨大潜力。另一方面,内源性cGAS- sting通路通常被病变细胞释放的双链DNA (dsDNA)片段激活,并被细胞质DNA传感器cGAS识别。因此,DNA损伤化疗药物通常被认为释放dsDNA,通过cGAS-STING途径进一步激活先天免疫系统。
该研究提供了一种新的“单分子多靶点”CIT药物,该药物由DNA损伤剂顺铂和STING激动剂MSA-2结合而成。该工作表明,基于单分子的药物组合可能是未来一种有效的方法。单分子药物组合的易于管理和剂量也使它们在临床中成为更有利的选择。
原文链接:
https://doi.org/10.1093/nsr/nwae020
来源 | iNature(公众号)
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






