精神压力如何伤肠道?Cell子刊发文,中国药科大学郝海平/郑啸/王广基等合作揭晓肠菌介导的脑-肠轴机制
大脑和肠道错综复杂地联系在一起,并对各种刺激做出反应。压力诱导的脑-肠通讯与肠道疾病的发病机制和复发有关。将心理压力传递到肠上皮,导致适应不良的机制尚不清楚。
2024年1月23日,中国药科大学郝海平、郑啸、王广基及东南大学袁勇贵共同通讯在Cell Metabolism 在线发表题为“Psychological stress-induced microbial metabolite indole-3-acetate disrupts intestinal cell lineage commitment”的研究论文,该研究描述了压力反应脑-肠代谢轴,损害肠干细胞(ISC)谱系决定。
心理压力触发的交感神经输出丰富了肠道共生的鼠乳杆菌,增加了吲哚-3-醋酸酯(IAA)的产生,从而导致肠道分泌细胞的可转移性损失。细菌IAA破坏ISC线粒体生物能量,从而阻止细胞内在方式的分泌谱系承诺。口服α-酮戊二酸补充剂可促进ISC分化,并赋予压力引发的肠上皮损伤的恢复能力。该研究证实,精神困扰患者的粪便IAA较高,并与肠道功能障碍相关。这些发现揭示了一种微生物介导的脑-肠通路,可用于治疗压力驱动的肠-脑合并症。

在大脑和肠道之间存在一个精确而复杂的调节网络,以增加对环境挑战的综合适应。众所周知,肠道可以传递局部代谢、免疫和微生物信号,通知大脑和行为变化。反过来,中枢神经和内分泌输出调节肠道运动、粘膜免疫以及微生物生态。这种双向肠脑连接长期以来一直被认为参与机体压力反应,其对压力的不适应通常表现在肠易激综合征(IBS)和炎症性肠病(IBD)等疾病中,传统疗法对这些疾病的治疗效果很差。最近,有报道称心理压力可触发单核细胞介导的肠道炎症,从而加剧IBD,揭示了精神压力对肠道炎症影响的机制。然而,关键问题仍然存在,例如远端脑压力源如何在肠道界面被感知,以及哪些信号分子将控制传递给肠道上皮紊乱。
肠道干细胞(ISCs)高度协调的增殖和分化对肠道上皮细胞的更新和稳态至关重要,以应对各种挑战。众所周知,ISCs对来自邻近Paneth细胞、基质细胞和免疫细胞的各种生态位信号以及各种外部信号(如饮食成分和微生物组)产生动态响应。然而,在心理压力的背景下,这些信号是如何重新连接来决定ISC命运的,仍知之甚少。
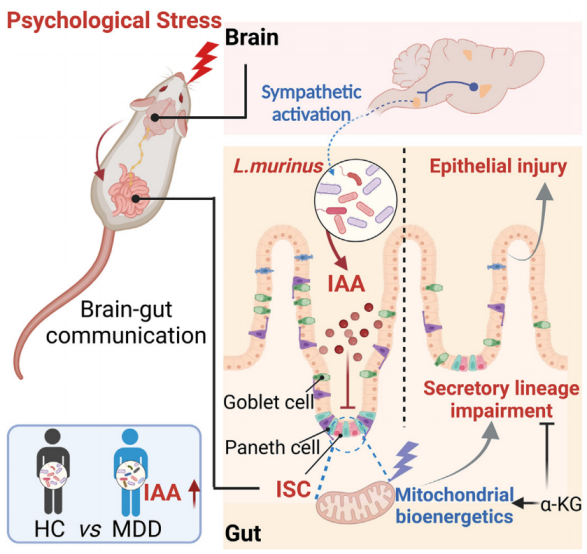
作为肠脑串扰的关键调节者,肠道微生物群是由心理因素动态塑造的先前的研究表明,压力条件下该属的多种细菌(如乳酸杆菌、拟杆菌和链球菌)的水平发生了变化,尽管对脑-肠信号传导的关键因素的共识和见解仍然有限。系统发育多样的微生物可能依赖相似的代谢物与宿主相互作用。有趣的是,之前的研究和其他研究表明,一些微生物代谢物是ISC增殖的重要调节因子。因此,微生物代谢物轴的鉴定可能有助于揭示肠道平衡是如何在心理压力下失去的。
该研究揭示了一种将心理压力传递到肠上皮功能障碍的脑-肠通路。通过宏基因组学、代谢组学、谱系追踪、代谢生物工程和肠道类器官技术,确定了乳酸杆菌衍生的吲哚-3-醋酸酯(IAA)是一种压力反应性中继信号,可触发ISCs分泌谱系决定的内在缺陷。在不同的心理困扰患者队列中验证了这一联系,并在小鼠中提供了概念验证证据,证明α-酮戊二酸(α-KG)补充剂可有效缓解压力驱动的肠道上皮损伤。总之,这些发现揭示了一个微生物介导的ISC命运决定的调控途径,这是压力驱动的脑-肠合并症的基础。
原文链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(23)00477-1
来源 | iNature(公众号)
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






