Cell子刊:果糖也能致癌?中国科学院卜鹏程等发现,果糖在不影响肥胖和相关并发症的情况下,也会促进结直肠癌的肿瘤发生和生长!
果糖通过结直肠上皮中酮己糖激酶介导的代谢与结直肠癌的肿瘤发生和转移有关,但其在肿瘤免疫微环境中的作用仍不清楚。
2024年10月28日,中国科学院生物物理研究所卜鹏程、温州医科大学沈贤、中国科学院大连化学物理研究所朴海龙共同通讯在Cell Metabolism(IF=27.7)杂志在线发表了题为“Hexokinase 2 senses fructose in tumor-associated macrophages to promote colorectal cancer growth”的研究论文,该研究发现适量的果糖在不影响肥胖和相关并发症的情况下,通过抑制M1样巨噬细胞的极化,促进结直肠癌的肿瘤发生和生长。
果糖独立于果糖介导的代谢抑制M1样巨噬细胞极化。相反,它作为一个信号分子促进己糖激酶2和肌醇1,4,5-三磷酸受体3之间的相互作用,肌醇1,4,5-三磷酸受体3是内质网上主要的Ca2+通道。这种相互作用降低了细胞质和线粒体中的Ca2+水平,从而抑制了丝裂原活化蛋白激酶(MAPK)和转录信号换能器和激活因子1 (STAT1)的激活以及NOD-、LRR-和pyrin结构域蛋白3 (NLRP3)炎症小体的激活。因此,这阻碍了M1样巨噬细胞的极化。该研究强调了果糖作为一种信号分子在肿瘤生长中损害M1样巨噬细胞极化的关键作用。

在过去的2个世纪里,果糖的摄入量激增了100多倍过量的果糖经常导致肥胖和代谢综合征的发生,这两者都被认为是肿瘤发生的危险因素。最近的研究表明,即使在没有肥胖和代谢综合征的情况下,中等剂量的果糖也能改善野生型小鼠的肠道细胞存活,并促进大肠腺瘤性息肉病(APC)突变小鼠的结直肠癌(CRC)发生。许多研究表明,癌细胞可以有效地利用果糖作为其增殖和转移的额外能量来源。例如,在胰腺癌细胞中,多余的果糖通过非氧化戊糖磷酸途径(PPP)参与核苷酸合成。
同样,在急性髓性白血病细胞中,果糖主要通过己糖激酶(HK)而不是酮己糖激酶(KHK)代谢,导致果糖流入丝氨酸合成途径,支持急性髓性白血病(AML)的进展。之前的研究表明,醛缩酶-B是果糖代谢的关键限速酶,在结直肠癌肝转移中升高。此外,高果糖饮食已被证明可促进结直肠癌转移到肝脏。果糖在促进肿瘤进展中的作用逐渐认识,大多数研究都集中在其对肿瘤细胞的直接影响上。然而,肿瘤的进展是由肿瘤微环境(TME)复杂调节的。TME中的许多其他成分,包括免疫细胞和微生物,在肿瘤进展中起着重要作用。然而,果糖对TME的影响在很大程度上仍未被探索。
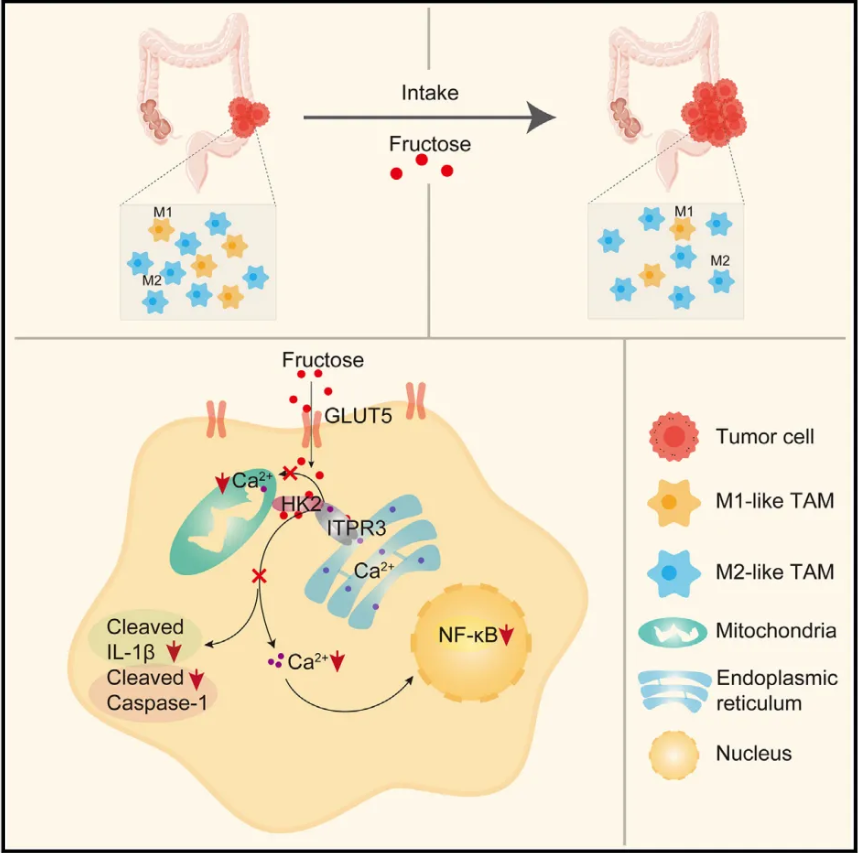
高果糖饮食促进结直肠癌进展的机制图(图源自Cell Metabolism)
肿瘤相关巨噬细胞(TAMs)是TME不可或缺的一部分,构成了一个动态的、异质性的细胞群,对肿瘤的进展至关重要。TAM在肿瘤进展中具有双重功能:它们可以诱导炎症反应以抑制肿瘤生长(M1 样巨噬细胞),还可以促进血管生成并促进肿瘤免疫逃逸以维持肿瘤生长(M2 样巨噬细胞)。据报道,果糖对LPS刺激的巨噬细胞具有促炎作用,主要依赖于谷氨酰胺水解和氧化代谢。在葡萄糖代谢中,M1样巨噬细胞通过有氧糖酵解和PPP活性的增加而被激活并分泌炎症细胞因子。相反,M2样巨噬细胞依靠氧化磷酸化(OXPHOS)来维持其免疫抑制状态。尽管果糖广泛存在,但对其对TAM极化的影响知之甚少。
在该研究中,研究人员表明,中等剂量的果糖摄入虽然不会导致肥胖和代谢综合征,但也会促进结直肠癌的生长。此外,果糖通过直接抑制M1样的TAM极化而独特地下调TAM的比例。所有这些都表明果糖在肿瘤进展中的不同作用在很大程度上取决于不同的肿瘤发生部位及其微环境成分。该研究揭示了果糖作为信号分子通过抑制M1-like TAMs极化促进结直肠癌发生和生长的新功能,丰富了果糖调控细胞活性的作用机制。
中国科学院生物物理研究所卜鹏程研究员、温州医科大学沈贤教授和中国科学院大连化学物理研究所朴海龙研究员为论文的共同通讯作者。卜鹏程课题组晏荟文助理研究员,首都医科大学附属北京朝阳医院王智博士 (卜鹏程课题组毕业博士生) ,解放军总医院腾达博士,温州医科大学陈孝东博士为论文共同第一作者。中国科学院生物物理研究所卜鹏程组博士生朱子敬、朱冰组博士生卫子源、朱平组王有望博士,中国科学院微生物研究所朱明昭组柴谦副研究员,中国科学院大连化学物理研究所陈欢博士和王稳博士为该研究提供了帮助。
原文链接:
https://www.cell.com/cell-metabolism/abstract/S1550-4131(24)00398-X
来源 | iNature
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






