Nat Commun | 中山大学杨扬等团队合作发现改善移植老年肝脏后缺血/再灌注损伤发生的临床方法
老年肝脏更容易发生肝缺血/再灌注损伤(HIRI),严重限制了其在肝移植中的应用,但尚不清楚其潜在发生机制。
2024年6月4日,中山大学杨扬、郑俊、姚嘉及张英才共同通讯在Nature Communications 在线发表题为“FTO deficiency in older livers exacerbates ferroptosis during ischaemia/reperfusion injury by upregulating ACSL4 and TFRC”的研究论文。该研究表明老年肝脏发生HIRI时铁死亡程度增加,抑制铁死亡可显著改善HIRI。质谱分析显示, HIRI期间,老年肝脏中脂肪量和肥胖相关基因(FTO)表达下调。FTO过表达能够通过抑制铁死亡来改善HIRI表型。
从机制上讲,酰基辅酶A合成酶长链家族4(ACSL4)和转铁蛋白受体蛋白1(TFRC)是铁死亡发生的两个关键因子,也是FTO的靶点。为改善HIRI,FTO需要以m6A依赖性方式抑制Acsl4和TfrcmRNA活性。此外,作者证明烟酰胺单核苷酸可以上调FTO去甲基化酶活性,抑制铁死亡并改善老年肝脏HIRI。总得来说,上述发现揭示了FTO-ACSL4/TFRC途径调控老年肝脏HIRI发病机制,提供了FTO去甲基化酶活性相关的临床治疗方法,以改善老年供体肝移植后的活性功能。

肝移植期间往往会发生肝缺血/再灌注损伤(HIRI),HIRI使患者易发生早期同种异体移植功能障碍(EAD)和移植后的排斥反应。重要的是,随着移植物的严重短缺和人口迅速老龄化,过去不用于移植的老年供体器官越来越多地用于临床,虽然能够缩小供需差距,.衰老对肝功能的影响虽然小于对肾脏或心脏功能的影响,但老年肝脏的外界应激能力明显低于年轻肝脏。如老年肝脏更容易受到IRI的影响,严重限制了老年肝脏在肝移植中的应用。因此,迫切需要揭示IRI分子作用机制,以开发有效减轻老年肝脏IRI的新型治疗方法。
铁死亡是一种铁依赖性磷脂过氧化介导的细胞死亡形式,据报道,铁死亡参与多种疾病的发生和发展。肝脏是铁储存的最重要器官之一,与各种形式的肝脏疾病(如HIRI)密切相关。Yamada等首次证明铁死亡影响HIRI的发生,铁抑素-1(Fer-1)抑制铁死亡可以有效缓解HIRI[1]。Wu发现泛素连接酶E3HUWE1/MULE靶向转铁蛋白受体蛋白1(TFRC)的降解,以抑制HIRI期间的铁死亡[2]。跨膜成员16A(TMEM16A)促进谷胱甘肽过氧化物酶4(GPX4)的泛素化和降解,从而加重HIRI。老年肝脏更容易出现脂质紊乱和线粒体衰竭,且铁离子随着年龄的增长在肝脏中进一步积累,作者推测老年肝脏更容易发生铁死亡。然而,尚不清楚铁死亡在老年HIRI中的作用,揭示其发生机制对开发减轻老年HIRI的有效疗法至关重要。
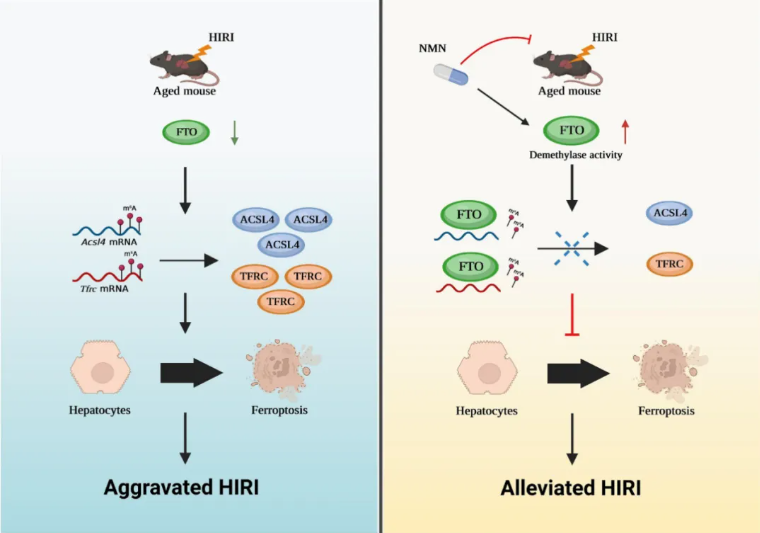
老年肝脏 FTO低表达上调ACSL4和TFRC加剧缺血/再灌注损伤期间铁死亡(摘自Nature Communications )
N6-甲基腺苷(m6A)是一种广泛分布且高度保守的RNA修饰,在真核生物的转录后基因调控中起关键作用,包括RNA剪接、翻译和降解。m6A是一种与应激反应有关的动态可逆修饰,近期研究报道了m6A修饰在心肌、肾脏、大脑和其他组织中调控IRI的作用。Du等首先证明了肝脏m6A甲基化在HIRI过程中的功能重要性[3],但m6A修饰在老年肝脏发生HIRI过程中的相关作用机制在很大程度上是未知的。
该研究利用临床标本、体内外实验评估了铁死亡在老年肝脏HIRI中的关键作用。作者发现,老年肝脏中低水平的脂肪量和肥胖相关基因(FTO)低表达促进了酰基辅酶A合成酶长链家族4(Acsl4)和Tfrc的转录后m6A修饰,是铁死亡的关键响应因子,在IRI期间表达量明显升高。此外,作者证明烟酰胺单核苷酸(NMN)是NAD+的重要前体,可增加FTO去甲基化酶活性以抑制铁死亡,改善老年肝脏HIRI的发生,表明NMN可用于临床以改善老年供体肝移植后的活性功能。
参考文献:
[1] Yamada, N. et al. Iron overload as a risk factor for hepatic ischemia-reperfusion injury in liver transplantation: Potential role of ferroptosis. Am. J. Transpl. 20, 1606–1618 (2020).
[2] Wu, Y. et al. Ubiquitin ligase E3 HUWE1/MULE targets transferrin receptor for degradation and suppresses ferroptosis in acute liver injury. Cell Death Differ. 29, 1705–1718 (2022).
[3] Du, Y. D. et al. N6-methyladenosine demethylase FTO impairs hepatic ischemia-reperfusion injury via inhibiting Drp1-mediated mitochondrial fragmentation. Cell Death Dis. 12, 442 (2021).
参考消息:
https://www.nature.com/articles/s41467-024-49202-3
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






