Cell子刊 | 复旦大学研究团队揭示了三阴性乳腺癌“冷到热”转变的关键介导因子!
虽然在免疫治疗时代,三阴性乳腺癌(TNBC)的预后有了明显改善,但许多TNBC患者对治疗有耐药性,病情进展迅速。破译调节抗癌免疫的代谢机制将为TNBC的治疗策略提供新的见解。
2024年11月8日,复旦大学Liu Guang-yu、江一舟、Gong Yue共同通讯在Med(IF=12.8)杂志在线发表了题为“DHDH-mediated D-xylose metabolism induces immune evasion in triple-negative breast cancer”的研究论文,该研究发现DHDH介导的右旋木糖(D-xylose)代谢诱导三阴性乳腺癌的免疫逃逸。
在机制上,DHDH介导底物D-木糖的合成和消耗,抑制蛋白酶体亚基-9型(PSMB9)的激活和进一步诱导免疫反应。补充D-木糖可以增强CD8+ T细胞的增殖和细胞毒性标记物对共培养的DHDH-野生型(WT)细胞的表达。一致地,体内补充D-木糖促进CD8+ T细胞浸润和细胞毒性标志物的表达,并增加过表达DHDH的肿瘤对免疫检查点阻断(ICB)的敏感性。该研究结果表明,D-木糖调节的PSMB9依赖途径控制肿瘤固有的免疫原性,从而控制对ICB的敏感性,这可能为促进TNBC的“冷到热”转变提供了途径。

三阴性乳腺癌(three -negative breast cancer,TNBC)是一种以雌激素受体和孕激素受体缺乏表达以及人表皮生长因子受体2(human epidermal growth factor receptor, HER2)基因扩增缺失为病理学定义的乳腺癌,其侵袭性和异质性是众所周知的,是乳腺癌不同分子亚型中预后最差的。目前,化疗仍然是TNBC的标准治疗选择,尽管免疫检查点阻断(ICB)疗法在新辅助和辅助治疗中取得了巨大成功。然而,由于疾病的异质性,许多TNBC患者由于免疫浸润低、免疫细胞耗竭程度高以及许多其他因素而表现出免疫治疗抵抗。因此,由于免疫疗法对某些TNBC患者的有效治疗,发现和探索与免疫逃避有关的基因正成为广泛研究的焦点。
代谢重编程被认为是致癌和癌症进展的标志有证据表明,代谢途径、代谢酶和代谢物可能在肿瘤免疫微环境(TIME)和癌细胞之间的信号传导、相互作用和调节中起调节作用。之前的工作揭示了中国人群中TNBC的转录组学、基因组学和代谢组学景观。多组学分析表明,靶向代谢重编程可以增强针对TNBC的免疫治疗效果。
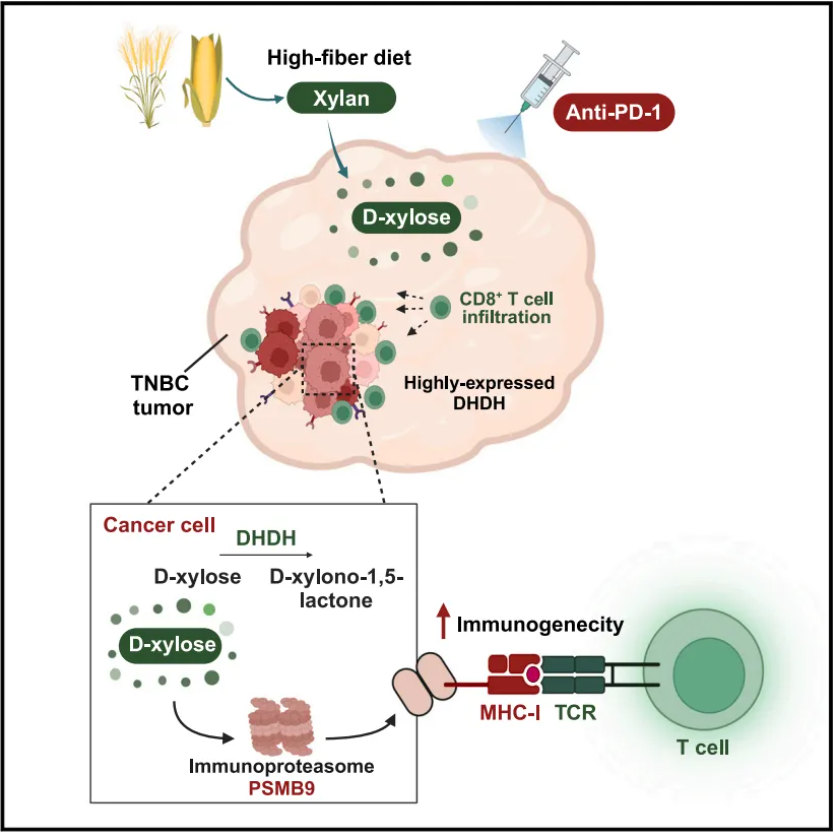
机理模式图(图源自Med)
研究结果表明,TNBC可以分为以下三种亚型,它们具有不同的基于时间的特征:第1类(“免疫荒漠”),第2类(“先天免疫失活”)和第3类(“免疫炎症”)。虽然已经建立了一个精确的分类系统来识别“热”肿瘤(cluster 3),这些肿瘤高度表达免疫检查点分子,并将受益于ICB治疗,但这一群体仅占所有TNBC的28%。因此,识别免疫炎性肿瘤,将非免疫炎性肿瘤转化为免疫炎性肿瘤,以及增加联合免疫治疗的益处是新出现的临床问题。
该研究利用FUSCC TNBC多组学数据进行生物信息学分析,发现了与低免疫浸润相关的关键代谢酶—二氢二醇脱氢酶(DHDH)。体内补充D-木糖可促进CD8+ T细胞浸润和细胞毒性标志物的表达,并增加过表达DHDH的肿瘤对免疫治疗的敏感性。总之,该研究确定了一个关键的代谢分子DHDH,它介导“冷”TNBC肿瘤的形成,补充D-木糖联合抗PD-1抗体为高DHDH表达的TNBC患者提供了一种新的治疗策略。
原文链接:
https://www.cell.com/med/abstract/S2666-6340(24)00410-0
来源 | iNature
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






