Nat Commun:天津医科大学王晓虹等团队研究强调O-GlcNAc-Hippo轴在糖尿病视网膜病变发病机制中的关键作用
代谢紊乱显著导致糖尿病血管并发症,包括糖尿病视网膜病变,这是工作年龄人群失明的主要原因。然而,代谢稳态紊乱导致糖尿病视网膜病变血管功能障碍的分子机制尚不清楚。O-GlcNA酰化修饰充当对环境葡萄糖特别敏感的营养传感器。
2024年10月29日,天津医科大学王晓虹,颜华共同通讯在Nature Communications 在线发表题为“Protein O-GlcNAcylation coupled to Hippo signaling drives vascular dysfunction in diabetic retinopathy”的研究论文,该研究强调了O-GlcNAc-Hippo轴在糖尿病视网膜病变发病机制中的关键作用,并表明其作为治疗靶点的潜力。
研究观察到糖尿病视网膜病变患者和小鼠模型的视网膜内皮细胞中O-GlcNAc明显升高。内皮特异性耗竭或O-GlcNAc转移酶的药理学抑制可有效缓解血管功能障碍。从机制上讲,研究发现Hippo通路的关键效应器Yes-associated protein(YAP)和带有PDZ结合基序的转录共激活物(TAZ)在糖尿病视网膜病变中被O-GlcNA酰化。将苏氨酸383鉴定为YAP上的O-GlcNAc位点,该位点抑制其丝氨酸397的磷酸化,导致其稳定和激活,从而通过诱导促血管生成和葡萄糖代谢转录程序促进血管功能障碍。

糖尿病的血管并发症,包括动脉粥样硬化、糖尿病肾病和视网膜病变,是该疾病最严重的表现之一。在这些并发症中,糖尿病视网膜病变(DR)是全球视力丧失和失明的主要原因。DR的特征是早期微血管异常,如周细胞损失、微动脉瘤和非增殖阶段的视网膜内出血(非增殖性糖尿病视网膜病变,NPDR)。此阶段受损的血视网膜屏障(BRB)功能可导致糖尿病黄斑水肿(DME),这是DR视力受损和失明的主要原因。该疾病可进展到增殖阶段(增殖性糖尿病视网膜病变,PDR),其特征是新生血管形成、玻璃体收缩和视网膜脱离。虽然激光光凝和血管内皮生长因子(VEGF)中和疗法是治疗DR的常见方法,但它们有局限性。激光光凝疗法可以破坏视网膜组织,导致暗点,而抗VEGF疗法在增殖性视网膜病变中的有效性受到频繁干预的限制,因为这些药物的作用是短暂的。此外,一些患者可能对VEGF靶向药物反应不佳或没有反应,在某些情况下,VEGF中和会加速光感受器的萎缩。因此,为了制定更有效和可持续的治疗策略,加深我们对糖尿病视网膜病变发病机制的理解势在必行。
内皮细胞(EC)形成血管的最内层,使其与血液直接接触,并使其能够感知血液中的营养水平。EC表现出高的糖酵解活性,以与许多癌症细胞相似的速率消耗葡萄糖,并且主要依赖糖酵解产生约85%的ATP。糖酵解的几个关键调节因子,包括PFKFB3、ADORA2A和HK2,已被证明在调节内皮细胞能量稳态和血管生成方面发挥着关键作用。然而,这些代谢信号如何转化为蛋白质修饰和基因转录仍有待澄清。
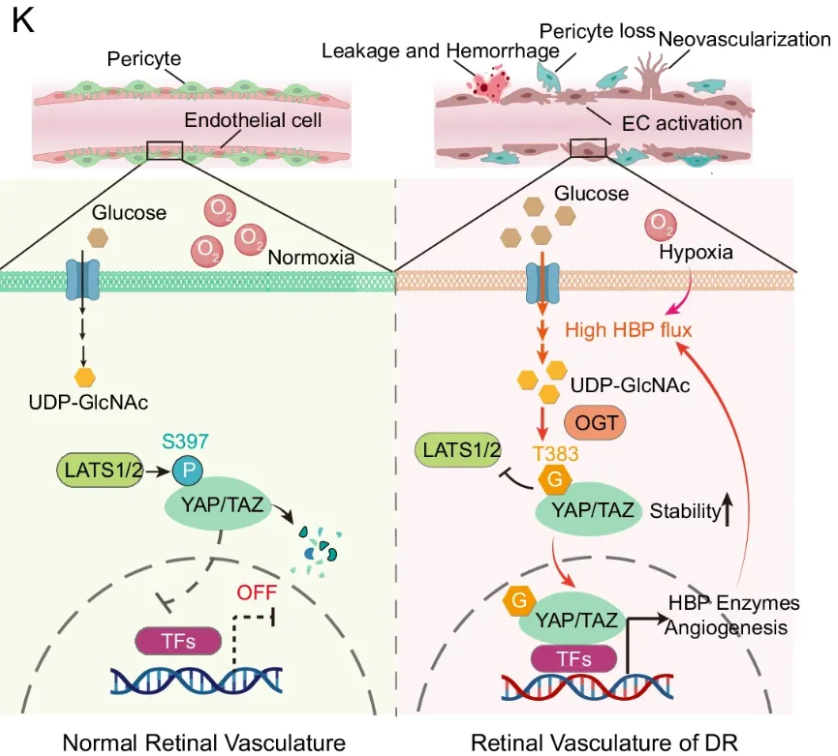
O-GlcNA酰化通过调节YAP/TAZ在调节DR血管功能障碍中的作用(图源自Nature Communications )
蛋白质的O-GlcNA酰化修饰充当营养物质的传感器,特别是环境中的葡萄糖水平。葡萄糖可以分流到糖酵解的一个分支己糖胺生物合成途径(HBP)中,产生UDP-GlcNAc,作为O-GlcNAcylation的供体分子。O-GlcNA酰化是一种重要的翻译后修饰,由O-GlcNAc转移酶(OGT)和O-GlcNALase(OGA)在蛋白质丝氨酸/苏氨酸残基上可逆催化,OGA是一对负责从蛋白质中添加和去除O-GlcNAc部分的酶。进入细胞的葡萄糖量直接影响UDP-GlcNAc的可用性,因此,O-GlcNAcylation受到环境葡萄糖的严格调节。O-GlcNAc稳态失调与多种慢性人类疾病有关,包括心血管疾病、阿尔茨海默病和癌症。尽管如此,O-GlcNAc信号传导在调节内皮细胞中的作用,特别是在糖尿病视网膜病变的情况下,仍然难以捉摸。研究了O-GlcNA酰化在糖尿病视网膜病变期间血管疾病中的作用,并评估了抗血管生成的治疗潜力。
参考消息:
https://www.nature.com/articles/s41467-024-53601-x
来源 | iNature
声明:本网站所有内容来源注明为“新医事”,版权均属于新医学事所有,未经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“新医事”。本网注明来源为其他媒体的内容为转载,或系自媒体发布的内容,仅系出于传递更多信息之目的,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。






